近日,best365英国体育在线钱旭红院士、杨泱泱副教授课题组在蛋白靶向降解策略研究中取得了重要进展,相关成果以“An Endoplasmic Reticulum (ER)-Targeting DNA Nanodevice for Autophagy-Dependent Degradation of Proteins in Membrane-Bound Organelles”为题发表于著名期刊Angew. Chem. Int. Ed. (DOI: 10.1002/anie.202205509),并入选VIP (Very Important Paper)。
蛋白质通过分布在胞内不同的细胞器中以执行各项功能,包括内质网(ER)、线粒体(Mito)等为代表的膜结合细胞器(Membrane-bound organelle,MBO)和以各类生物大分子凝聚体为代表的无膜细胞器(Membrane-bound organelle),例如ER为蛋白质的折叠、修饰提供了特定的生物环境,而ER内蛋白的异常表达和累积与肿瘤发生或者神经退行性疾病的发生都有关联,因此可靶向膜结合细胞器内蛋白质的调节工具将有助于开发靶向治疗的新策略。近年来,靶向蛋白降解策略已成为疾病治疗与干预的重要手段,目前基于泛素-蛋白酶体(UPS)机制所开发的PROTAC技术和基于自噬-溶酶体途径设计的AUTAC技术在降解胞外蛋白、膜蛋白以及胞质蛋白体现出广阔的应用前景。但由于MBO膜结构的限制,靶向MBO内的致病蛋白仍缺少有效降解工具。
研究团队利用具有ER靶向能力的DNA纳米器件(cDOS),设计并组装了一种可特定降解MBO内蛋白质的靶向工具。作者首先构建了一种具有肿瘤微酸性环境响应性的核酸-多肽偶联物(AMR)作为靶向肿瘤细胞的人工受体,通过碱基互补配对使肿瘤细胞可特异性摄取cDOS。随后cDOS通过小窝蛋白介导的内吞作用被细胞摄取,继而被转运至ER,最后通过自噬途径被转运至溶酶体降解。利用这一发现,在cDOS上通过自组装引入ER内蛋白结合配体(Ligand-ON)以构建靶向蛋白降解体(L-cDOS),当L-cDOS被运送至ER后,其与ER内靶向蛋白质结合,最后依赖自噬-溶酶体路径将结合的蛋白降解。
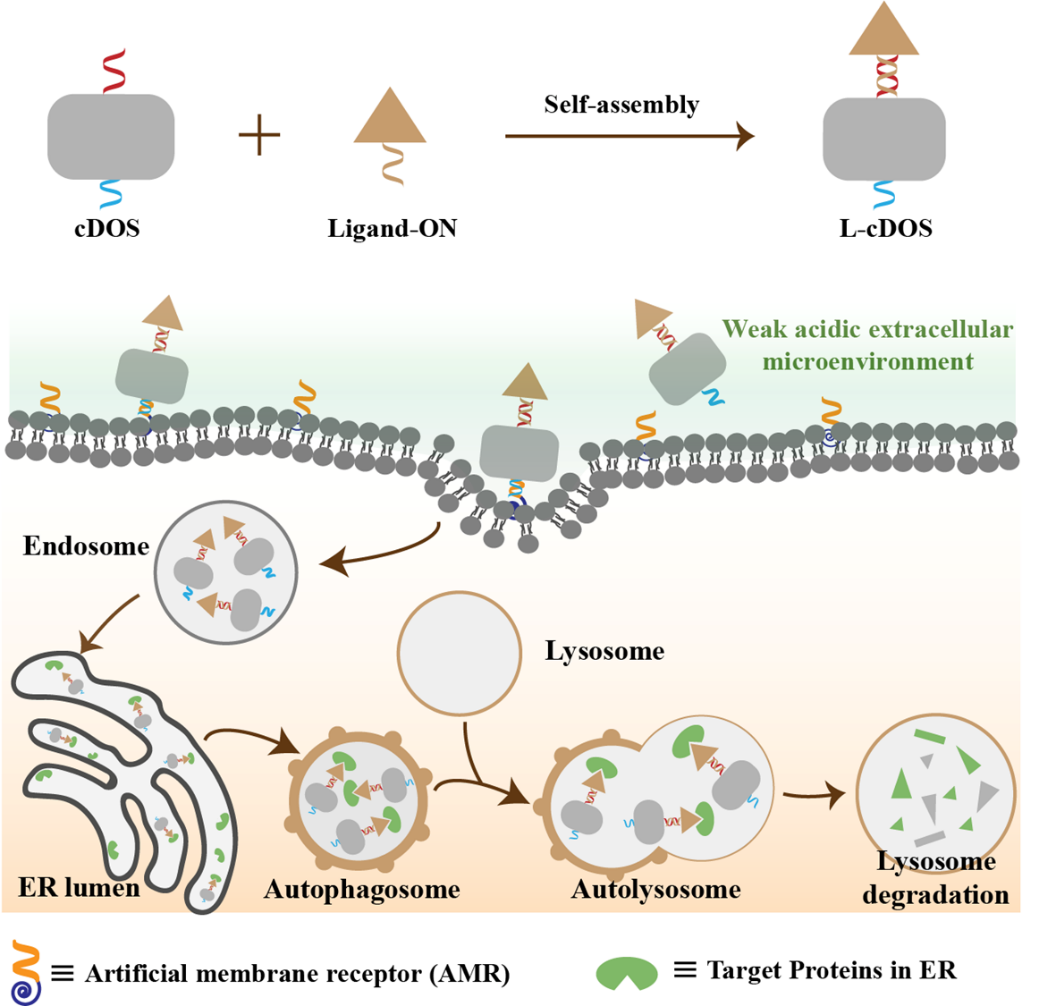
作者首先构建了在ER内表达的带有Halo标签的外源性融合蛋白ER-GFP,并同时组装可特异结合ER-GFP的靶向降解体(H-cDOS),然后利用免疫印迹法Western Blot(WB)验证了ER-GFP可被降解,从而证明了该策略的可行性。接着作者针对肿瘤细胞ER内过表达的分子伴侣GRP78,构建了特异的靶向降解体(S-cDOS),利用WB和免疫荧光成像技术验证了GRP78同样可被有效降解。该工作利用具有ER靶向能力的cDOS构建了一类自噬途径依赖的蛋白降解体系,能够高效降解膜结合细胞器内表达的蛋白质,为现有的蛋白靶向降解策略提供了一种新的工具。
best365英国体育在线2018级博士生刘彩霞为该工作的第一作者,该工作在钱旭红院士的悉心指导下完成,还得到了徐玉芳教授和朱维平教授的大力支持,并得到了国家自然科学基金、上海市科技重大专项等资金的支持。